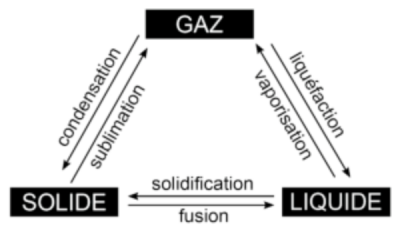
Définition : corps purs et mélanges
Corps purs et mélanges :
Un corps purs est composé d'une seule espèce chimique sous forme atomique ou moléculaire. Exemples : He, H2O, O2.
Un mélange est homogène si l'on ne distingue aucun constituant à l’œil nu.
Un mélange est hétérogène si l'on distingue à l’œil nu au moins deux constituants.
Méthode :
On peut identifier une espèce chimique à partir de certaines de ses caractéristiques physiques ou chimiques qui lui sont propres.
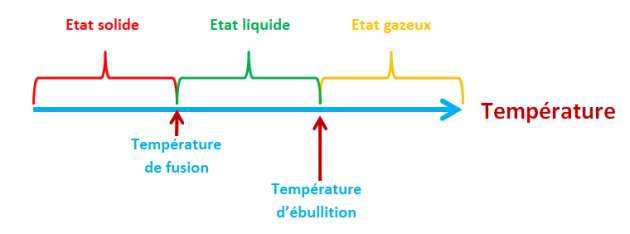
Les températures de changement d'état :
Si un corps est à une température inférieure à sa température de fusion, il est à l'état solide ;
S'il est à une température supérieure à sa température d'ébullition il est à l'état gazeux ;
Entre ces deux températures, il est à l'état solide.
Remarque : un changement d'état s'effectue à une température constante uniquement pour un corps pur.
Définition : la masse volumique ρ
La masse volumique, notée ρ (rho), d'une espèce chimique est le rapport entre une masse m de cette espèce et le volume V correspondant (elle dépend de la température et de la pression).
On a la relation suivante : m = ρ . V
On utilise souvent comme unité pour la masse volumique le kg.L-1 ou g.mL-1.
.
La masse volumique de l'eau pure est égale à 1,0 kg.L-1.
Remarque :
La densité d'un liquide, notée « d » est donnée par la relation ci-contre.
L'éthanol a pour masse volumique 0,789 kg.L-1, sa densité est donc égale à ......................................
.
.
\(d=\frac{\rho (liquide)}{\rho (eau_{pure})}\)