Structure de l'atome
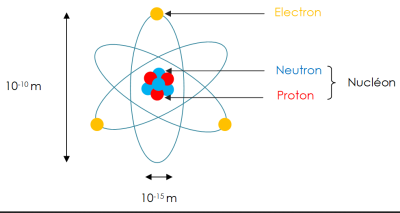
L'atome est constitué d'un noyau autour duquel gravitent un cortège d'électrons.
.
L'ordre de grandeur de la taille d'un atome est de 10-10 m.
Le noyau est 100 000 fois plus petit que l'atome soit 10-15 m.
Le noyau
Le noyau d'un atome est constitué de deux types de particules (protons et neutrons) que l'on appelle les nucléons :
les protons portent une charge électrique positive notée « e » ou « +e » : e = 1,6 . 10-19 C
Le « Coulomb » de symbone « C » est l'unité de charge électrique.
Leur masse est mp = 1,67 . 10-27 kg.
les neutrons sont électriquement neutres.
Neutrons et protons ont une masse identique : mn = mp
.
Le noyau d'un atome est chargé positivement.
Représentation symbolique du noyau d'un atome
| 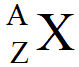 |
Le cortège d'électrons
Les électrons sont des particules chargées négativement de charge électrique notée « - e » = - 1,6 . 10-19 C.
Un atome étant électriquement neutre, il y a autant d'électrons que de protons dans l'atome : Il y a donc Z électrons dans l'atome.
Les électrons ont une masse me = 9,1 . 10-31 kg.
La masse de l'atome est concentrée dans le noyau car la masse des électrons est négligeable devant la masse des nucléons (2000 fois plus faible).
.
Complément : charge électrique du noyau d'un atome
La charge électrique notée " Q " du noyau d'un atome dépend du nombre de protons ( Z ) présents dans le noyau et de la charge électrique d'un proton notée "e".
Q(noyau) = Z x e
L'unité de charge électrique est le Coulomb de symbole C.
Complément : masse du noyau d'un atome
La masse du noyau d'un atome dépend de son nombre de nucléons A et de la masse d'un nucléon, notée m(nucléon).
La masse d'un nucléon, c'est la masse d'un proton ou d'un neutron.
.
m(noyau) = A x m(proton)
Définition : qu'est-ce qu'un élément chimique ?
Un élément chimique est caractérisé par son nombre de protons Z et on lui associe toujours le même symbole.
Quelques exemples :
H : | C : | O : | N : |
.
Définition : qu'est-ce qu'un isotope ?
Deux isotopes ont même nombre de protons ( Z ) mais un nombre de nucléons ( A ) différent : ils n'ont donc pas le même nombre de neutrons.
Deux isotopes appartiennent donc au même élément chimique puisqu'ils ont le même nombre de protons, ils ont donc le même symbole.
Remarques :
Deux isotopes ont les mêmes propriétés chimiques.
Dans la nature, les isotopes se trouvent avec des abondances qui sont souvent différentes pour un même élément (l'hydrogène est beaucoup abondant que le deutérium ou le tritium).
Quelques exemples d'isotopes de l'élément hydrogène :
\(^{1}_{1}H\), deutérium \(^{2}_{1}H\), tritium \(^{3}_{1}H\)
.