Attention : Situation problème
Comment identifier un élément chimique responsable de la couleur d'une flamme ?
Objectifs :
Découverte des différents types de spectres.
Produire et exploiter des spectres d'émission obtenus à l'aide d'un système dispersif et d'un analyseur de spectre.
Identification d'éléments chimiques par spectroscopie.
Matériel au bureau :
|
|
Attention : réalisation d'un compte-rendu de TP en vidéo
Pour ce TP vous allez devoir réaliser un compte-rendu de TP en binôme sous forme d'une capsule vidéo.
Répondre par écrit, sur feuille, aux questions posées afin d'avoir tous les éléments pour la réalisation de la vidéo.
N'oubliez pas de réaliser des photographies ou de courtes vidéos des expériences réalisées en évitant de filmer le visage de l'un de vos camarades.
Vous pourrez ensuite incorporer un bande son sur votre vidéo pour décrire ce que vous faîtes ou pour formuler une conclusion.
Vous devez installer l'application gratuite INSHOT (montage vidéo et photo) disponible pour Iphone et pour Androïd. Utiliser le tutoriel proposé.
.
Vous me ferez ensuite parvenir votre vidéo en utilisant la service en ligne « drop.chapril.org » : il faudra alors m'envoyer un message sur Pronote afin que vous m'indiquiez le lien de téléchargement.
Complément :
Rappel : compétences mises en jeu & auto-évaluation
S'approprier | rechercher et organiser l’information en lien avec la problématique posée | A | B | C | D | E |
Réaliser | mettre en œuvre un protocole expérimental en respectant les règles de sécurité. | A | B | C | D | E |
Communiquer | présenter une démarche de manière argumentée, synthétique et cohérente | A | B | C | D | E |
utiliser un vocabulaire scientifique adapté | A | B | C | D | E | |
pertinence des éléments visuels utilisés | A | B | C | D | E | |
qualité des éléments visuels (images rognées, légendes adaptées...) | A | B | C | D | E | |
qualité de la « mise en scène », du scénario proposé | A | B | C | D | E | |
qualité et pertinence des éléments audio | A | B | C | D | E |
Vous allez utiliser un spectroscope artisanal constituée par un tube en PVC, à l'une des extrémités on trouve une fente très fine (constituée par des lames de rasoir, attention à son utilisation, risque de coupure) et de l'autre côté par un réseau.
Un réseau est constitué par une plaque transparente sur laquelle sont représentés de nombreux traits parallèles entre eux : on peut ainsi obtenir des réseaux avec 140 traits / millimètre, 530 ou 740 traits / mm.

Observer le spectre de la lumière blanche obtenu à partir du réseau de 140 traits / mm fixé sur le rétroprojecteur.
.
1. Comparer les spectres obtenus d'un même côté de la fente (on obtient la même chose de manière symétrique de l'autre côté de la fente).
2. Décrire les changements obtenus lorsque l'on utilise un réseau avec 740 traits/mm.
Spectre continu
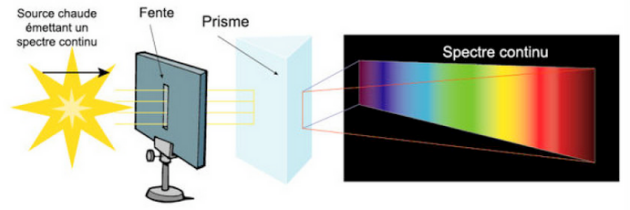
Utiliser le spectroscope artisanal qui est mis à votre disposition pour observer la lumière blanche issue du projecteur de diapositive, la fente du spectroscope est dirigée vers la source lumineuse et le réseau doit être situé du côté de votre œil.
.
3. Observer la disposition des radiations lumineuses les unes par rapport aux autres. Pourquoi dit-on que l'on obtient un spectre continu ?
Spectre de raies
Spectre d'émission d'un tube néon :

Observer avec votre spectroscope la lumière d'un tube néon.
4. Décrire le spectre d'émission obtenu puis justifier le terme de spectre de raies obtenu pour ce type de spectre..
Lampes à vapeur de mercure et de sodium :
5. Quelles sont les radiations lumineuses présentes dans un spectre d'émission d'une lampe à vapeur de mercure ?
Pour davantage de précision, vous pouvez utiliser le spectroscope à vision directe disponible au bureau ou le spectrophotomètre.
6. Même question pour une lampe à vapeur de sodium ?
7. Peut-on dire que le spectre de l'une de ces lampes est monochromatique ? Justifier votre réponse.
Complément : Spectre d'émission
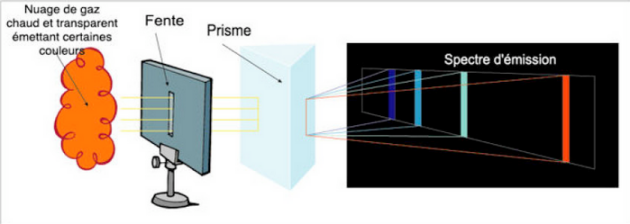
Le spectre d'émission, produit par tout gaz chaud et transparent ; c'est un spectre composé de raies étroites et brillantes de lumière sur un fond noir, lesquelles sont caractéristiques des éléments chimiques contenus dans le gaz.
C'est le cas d'un gaz produit par un brûleur ou d'une nébuleuse, par exemple. Une nébuleuse n'est en effet rien de moins qu'un nuage plus ou moins chaud de gaz et de poussières.
Spectre absorption

Le spectre d'absorption, où un gaz froid et transparent absorbe une partie de la lumière émise par une source chaude émettant un spectre continu, ce qui produit dans ce dernier une série de raies noires caractéristiques des éléments chimiques présents dans le gaz froid.
Observer au bureau le spectre obtenu lorsque l'on place une solution de sulfate de cuivre sur le trajet de la lumière blanche avant que le lumière ne traverse le réseau.
.
8. Décrire le spectre obtenu et le comparant au spectre continu de la lumière blanche d'une lampe.
Un peu d'histoire...
En 1859, le chimiste allemand Robert Wilhelm Bunsen (qui améliora et popularisa le brûleur qui porte son nom) utilise un moyen d'analyse plutôt original : il introduit des sels minéraux dans la flamme de son brûleur et observe les couleurs générées par le gaz produit. Il parvient ainsi à déduire si un constituant est présent ou non dans un minéral en observant la couleur qui, selon lui, le caractérise.
Gustav Robert Kirchhoff, un physicien allemand et ami de Bunsen, propose plutôt de disperser la lumière produite par le gaz avec un prisme de façon à générer un spectre. Les deux chercheurs font alors une découverte majeure : ils constatent que chaque élément chimique génère une série de raies spectrales qui le caractérise de façon unique, comme une empreinte digitale.
Une nouvelle technique analytique, la spectroscopie, vient ainsi d'être inventée et, grâce à elle, plusieurs nouveaux éléments chimiques sont découverts dans les années qui suivent.
.
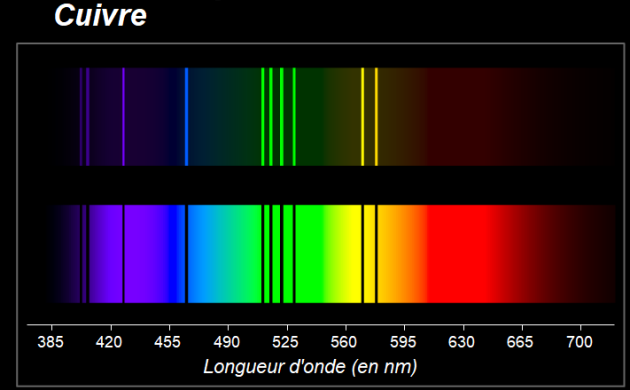
Observer les spectres suivants des éléments mercure, hélium et cuivre.
9. Comparer le spectre d'émission et le spectre d'absorption pour un même élément.
10. Pourquoi peut-on affirmer que le spectre d'un élément chimique constitue son "empreinte digitale" ?
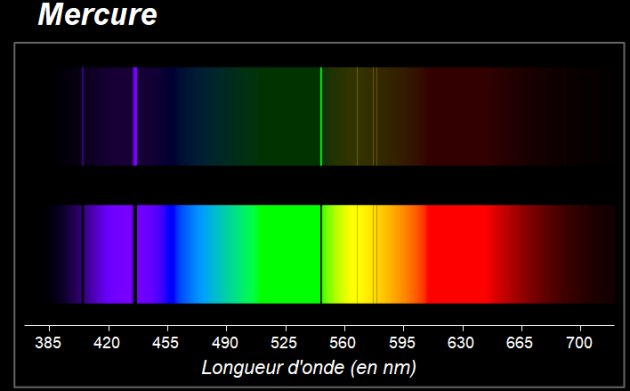 | 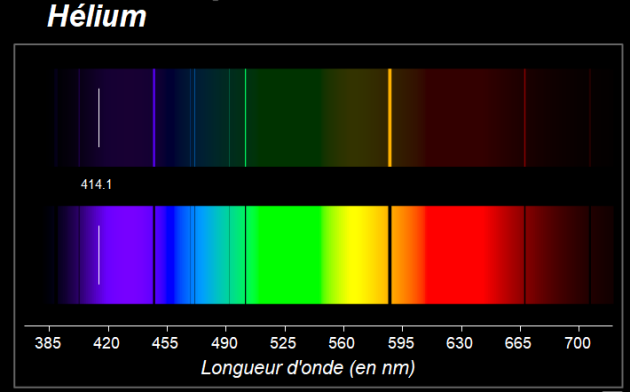 |  |
Tests de flammes
Observer la vidéo proposée avant de répondre aux questions proposées.
11. Comment et pourquoi réalise-t-on une flamme témoin avec l'éthanol ?
12. Pouvait-on prévoir la couleur de la flamme de la solution de chlorure de cuivre d'après le spectre d'émission précédent de l'élément cuivre ?
Expérience au bureau
Protocole expérimental :
Prendre un morceau de coton avec une pince et le plonger dans l'une des solutions (solutions alcooliques de chlorure de lithium, de chlorure de sodium et de chlorure de cuivre II).
Déposer ensuite ce coton sur l'une des coupelles.
Allumer une allumette et enflammer le coton. Réaliser et décrire le spectre de la flamme observée.
Si nécessaire, éteindre la flamme en plaçant le grand bécher au-dessus de la coupelle.
.
13. Répondre à la problématique initiale.
.
