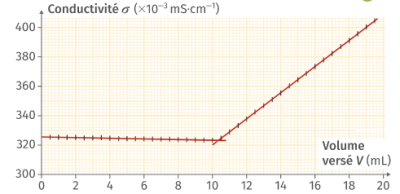
Exercice 1
Exercice 2
On réalise le titrage d'un volume V = 10,0 mL d'acide éthanoïque CH3COOH(aq) par de la soude de concentration c = 1,00×10−1 mol⋅L-1 en ions hydroxyde HO-.
Le volume versé à l'équivalence est VE=12,3 mL.
L'équation de la réaction de titrage est la suivante : CH3COOH + HO- → CH3COO- + H2O
Données : M(H) = 1,0 g.mol-1, M(C) = 12,0 g.mol-1, M(O) = 16,0 g.mol-1,
1. Que peut-on dire des réactifs à l'équivalence ?
2. Quelle relation peut-on écrire à l'équivalence entre les quantités de matière d'acide éthanoïque et d'ions hydroxyde en tenant compte des coefficients stœchiométriques.
3. Déterminer la quantité de matière d'ions hydroxyde versés à l'équivalence.
4. En déduire la concentration initiale en quantité de matière en acide éthanoïque.
5. Déterminer la masse molaire de l'acide éthanoïque.
6. En déduire la concentration massique en acide éthanoïque dans le volume prélevé pour effectuer le titrage.