Rappel : solution, solvant et soluté
Lorsque l'on dissout un soluté dans un solvant, on obtient une solution.
Lorsque le soluté est un composé ionique, on obtient une solution ionique (capable de conduire le courant électrique).
Lorsque le soluté est un composé moléculaire, on obtient une solution qui contient des molécules (la solution n'est pas conductrice).
.
Méthode : équation de dissolution d'un soluté ionique
Une solution est toujours électriquement neutre : elle contient autant de charges positives que de charges négatives.
Pour écrire une équation de dissolution d'un soluté ionique, on doit indiquer l'état physique des différentes espèces chimiques en tenant compte de l'électro-neutralité de la solution.
L'indication (aq) signifie, "dissout dans une solution aqueuse".
Exemple :
\(NaCl_{(s)} \longrightarrow \ Na^{+}_{(aq)} + Cl^{-}_{(aq)}\)
Il y a conservation du nombre d'atome et du nombre de charges électriques : "rien ne se perd, rien ne se créé, tout se transforme" (Cf Lavoisier).
Les coefficients stœchiométriques des ions formés dépendent de leurs charges électriques afin d'obtenir une solution neutre.
Exemple :
\(MgCl_{2(s)} \longrightarrow \ Mg^{2+}_{(aq)} + 2 Cl^{-}_{(aq)}\)
.
Rappel : concentration en masse Cm et concentration en quantité de matière C
La concentration en masse "Cm" dépend de la masse "m" de soluté dissoute et du volume "V" de solution obtenu.
m = Cm . V
Si la masse est en gramme et le volume en litre, on obtient une concentration en masse en "g . L-1".
.
La concentration en quantité de matière "C" dépend de la quantité de matière "n" de soluté dissoute et du volume "V" de solution obtenu.
n = C . V
L'unité pour la concentration en quantité de matière est "mol . L-1" (l'unité de la quantité de matière est la mole et l'unité du volume de solution est en litre).
Méthode : dilution et facteur de dilution
Pour diluer une solution aqueuse, il suffit de rajouter de l'eau à la solution.
Pour réaliser une dilution, on utilise un pipette jaugée pour prélever un volume précis de solution mère (la solution initiale) et une fiole jaugée pour obtenir un volume précis de solution diluée (la solution finale).
On ajoute environ 1/3 d'eau distillée au volume de solution mère prélevé, on agite le mélange obtenu, on rajoute de l'eau distillée jusqu'au trait de jauge puis on agite une dernière fois.
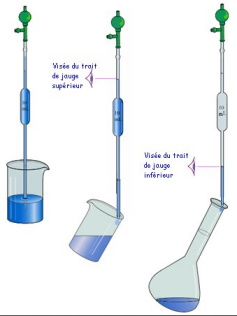
Au cours d'une dilution, la quantité de matière (ou la masse) de soluté ne change pas : la quantité de matière initiale de soluté est la même que la quantité de matière finale de soluté.
ninitiale = nfinale
ni = nf
Ci . Vi = Cf . Vf
.
Le facteur de dilution "F" est donné par la relation suivante :
\(F= \frac{Ci}{Cf}=\frac{Vf}{Vi}\)
Le facteur de dilution est toujours supérieur à 1 ( Ci > Cf et Vf > Vi ).
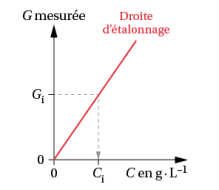
Méthode : dosage par étalonnage
Dans ce type de dosage, on utilise plusieurs solutions "étalons" qui contiennent l'espèce chimique à doser et dont la concentration est connue.
La concentration de l'espèce chimique à doser influe sur une grandeur physique "G" mesurable comme l'absorbance, la conductivité...
On utilise alors une courbe d'étalonnage pour déterminer la concentration de la solution à doser.
Remarques :
l'absorbance est une grandeur qui permet de connaître la quantité de lumière qui est absorbée par une solution : plus l'absorbance est élevée, plus la solution est concentrée et absorbe la lumière.
Les mesures d'absorbance sont toujours effectuées pour une valeur de longueur d'onde où l'absorbance est maximale.
