Solubilité des composés ioniques
Un composé ionique est formé de cations chargés positivement et d'anions chargés négativement.
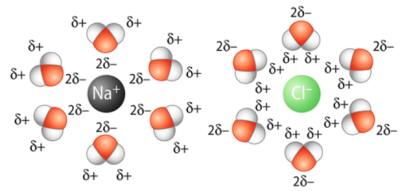
Les composés ioniques sont solubles dans l'eau : cette solubilité est liée au caractère polaire de la molécule d'eau (la molécule d'eau porte des charges partielles négatives sur l'atome d'oxygène et des charges partielles positives sur les atomes d'hydrogène).
Les cations et les anions vont se dissocier dans la solution aqueuse grâce au phénomène de solvatation des ions : les cations attirent et s'entourent des atomes d'oxygène des molécules d'eau alors que les anions attirent et s'entourent des atomes d'hydrogènes des molécules d'eau.
.
Définition : conductivité
La conductivité d'une solution, notée \(\sigma\), montre le caractère conducteur d'une solution :
Lorsque la conductivité est nulle, elle ne conduit pas le courant électrique : c'est le cas de l'eau pure.
Plus la conductivité est élevée, plus elle conduit le courant électrique et plus la quantité d'ions présente dans la solution est élevée.
La valeur de la conductivité dépend également de la nature des ions : certains ions conduisent davantage l'électricité que d'autres.
L'unité pour la conductivité est le Siemens par mètre, symbole S.m-1. L'appareil qui permet de mesurer la conductivité est un conductimètre.
.
Complément :
Une eau distillée ne contient pas de minéraux ni de bactérie (quelques gaz dissous : dioxygène et dioxyde de carbone).
Une eau déminéralisée ne contient pas de minéraux mais peut contenir des bactéries ce qui la rend impropre à un usage médical.
.
Méthode : concentration en ions
Lorsque l'on parle de concentration en ions, on utilise la notation suivante : [Na+] pour les ions sodium, [Cl-] pour les ions chlorure...
.
Complément : relation entre la concentration massique et la concentration en quantité de matière
Il existe la relation suivante entre la concentration massique Cm d'une espèce chimique en solution, sa concentration en quantité de matière C et la masse molaire de cette espèce chimique :
.
Cm = C x M
.
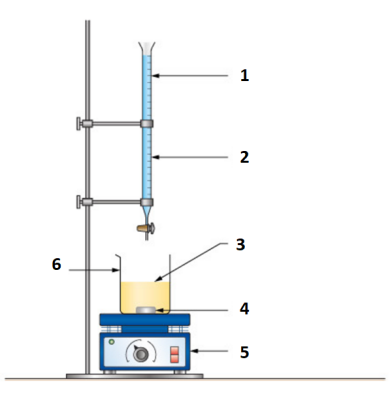
Méthode : dosage conductimétrique
Un dosage (ou titrage) conductimétrique a pour objectif de déterminer la concentration d'un ion en mesurant la conductivité de la solution au cours d'une réaction de dosage.
Dans ce type de dosage, la solution titrante est la solution dont la concentration en quantité de matière est connue et la solution titrée, la solution dont on ne connaît pas la concentration.
Généralement, la solution titrante est dans la burette et la solution titrée dans le bécher.
.
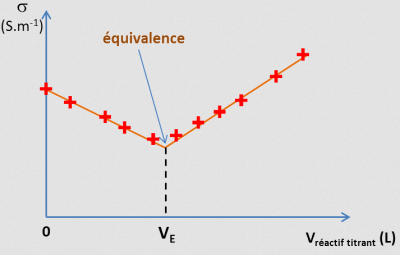
Définition : équivalence
On appelle équivalence, le moment où les réactifs sont dans des proportions stœchiométriques : ils réagissent alors totalement.
.
Complément : critères physico-chimiques de potabilité d'une eau
Pour qu'une eau soit potable , elle doit respecter certains paramètres microbiologiques (absence de bactéries...), organoleptique (au niveau du goût et de l'odeur) et physico-chimiques : le pH doit être proche de 7, la concentration de certains ions ne doit pas être trop élevée, la conductivité doit également être relativement faible...
Les activités humaines peuvent avoir un impact sur la qualité d'une eau : agriculture, eaux usées (résidus de médicaments), pollution plastique, pollution par les hydrocarbures...
On distingue les macro-polluants dont la concentration est voisine de 10-3 g.L-1 et les micro-polluants dont la concentration est beaucoup plus faible de 10-9 à 10-6 g.L-1.