Pourquoi les "têtes" des molécules de savon, à la surface de l'eau, sont-elles dans l'eau et leurs "queues" dans l'air ?
Qu'est-ce qu'un micelle ?
Pourquoi les tâches d'huiles sur un tissu peuvent-elles être éliminées par les molécules de savon ?
.
Méthode : l'action d'un savon dépend-elle de l'eau utilisée ?
Expérience 1 :
Dans 3 tubes à essai numérotés, introduire (sur une hauteur d'environ 5 cm) de l'eau distillée dans le tube n°1, une solution aqueuse de chlorure de calcium dans le tube n°2 et une solution de chlorure de magnésium dans le tube n°3.
Ajouter 5 gouttes de savon liquide dans chaque tube et agiter.
Noter vos observations pour chaque tube.
Dans quel tube la mousse est-elle la plus abondante ?
Un précipité est-il visible dans l'un des tubes ? Expliquer.
Une eau est qualifiée d'eau « dure » lorsqu'elle est riche en ions calcium ou magnésium. Dans quelles conditions un savon sera-t-il plus efficace ?
.
Le pouvoir mouillant :
L'eau ne s'étale pas toujours bien sur les surfaces à nettoyer : on dit qu'elle ne “mouille” pas bien ces surfaces.
Les molécules de tensioactifs s'insinuent entre les molécules d'eau (elles rompent les liaisons intermoléculaires reliant les molécules d'eau). Ainsi, le détergent "casse" les gouttes d'eau. Il permet à l'eau de mieux pénétrer dans les petits interstices entre les fibres des tissus ou de s'étaler correctement sur les surfaces.
L'eau savonneuse pénètre dans un tissu comme la laine ce qui provoque son immersion totale dans le bécher.
.
Le pouvoir dégraissant :
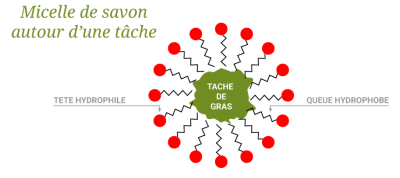
Les particules du détergent s'enfoncent dans les taches graisseuses du tissu.
Les queues hydrophobes et lipophiles adhérent à la surface de la graisse tandis que les têtes hydrophiles restent dans l'eau de lavage. Il se forme des micelles.
Les micelles se retrouvent dispersées dans l'eau savonneuse grâce à leur extrémité hydrophile lors du brassage.
Elles sont éliminées lors du rinçage.
.
Le pouvoir dispersant anti-rédéposant :
Les parties hydrophiles des micelles se repoussent les unes des autres, ce qui empêche toute redéposition des particules sur le support.
.
Le pouvoir moussant :
En agitant l'eau additionnée de liquide vaisselle, on fait s'y dissoudre de l'air d'autant plus facilement que la tension superficielle est faible. Les bulles d'air en s'entourant des queues hydrophobes forment de la mousse. Pour s'échapper du liquide, elles remontent à la surface en entraînant avec elles un film de liquide; il y a formation de bulles de savon en surface.
Les solutions de tensioactifs produisent de la mousse c'est-à-dire une émulsion d'air dans un liquide, les tensio-actifs ont un pouvoir moussant qui présente l'avantage d'accroître l'efficacité du produit en augmentant sa surface de contact avec la zone à nettoyer mais aussi l'inconvénient de rendre le rinçage du détergent difficile si elle est présente en grande quantité.
.
Complément : perte d'efficacité
Une eau dure, qui contient des ions calcium et magnésium, fait précipiter les molécules de tensioactifs et donc diminuer les propriétés lavantes des tensioactifs.
Pour des raisons similaires, il ne faut pas utiliser les tensioactifs dans le l'eau acide ou dans de l'eau salée.
.