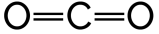Rappel : corps pur, mélange et solution aqueuse
Un corps purs est composé d'une seule espèce chimique sous forme atomique ou moléculaire. Exemples : He, H2O, O2.
Un mélange est homogène si l'on ne distingue aucun constituant à l’œil nu.
Un mélange est hétérogène si l'on distingue à l’œil nu au moins deux constituants.
.
Définition : qu'est-ce qu'une solution aqueuse ?
Une solution est un mélange homogène obtenu par dissolution d'un ou plusieurs solutés dans un solvant. Le soluté est l'espèce chimique dissoute en solution.
Le solvant est l'espèce chimique majoritaire dans la solution, dans une solution aqueuse, le solvant est l'eau.
.
Complément : solvant polaire
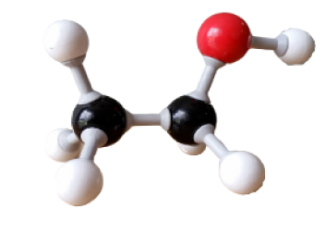
Dans la molécule d'eau, chaque atome d'hydrogène forme une liaison covalente (constituée par deux électrons) avec l'atome d'oxygène. C'est une molécule coudée. | 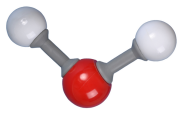 | 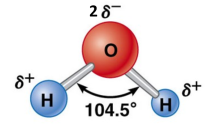 |
.
L'eau est un solvant "polaire" : elle possède des liaisons polarisées et le barycentre des charges partielles positives et négatives n'est pas confondu, le "centre géométrique" des charges partielles positives n'est pas au même endroit que le centre géométrique des charges partielles négatives.
Une molécule est soit polaire, soit "apolaire".
.
Solubilité d'une espèce chimique dans un solvant
La masse maximale de soluté que l'on peut dissoudre dans un litre de solvant s'appelle la solubilité : lorsque l'on ne peut plus dissoudre de soluté dans un solvant, on obtient une solution saturée.
Remarques :
la solubilité dépend de la température, généralement, elle augmente avec la température.
Les solvants polaires sont capables de dissoudre les composés ioniques et les molécules polaires ce qui n'est pas possible avec des solvants apolaires (on a alors une solubilité nulle).
Méthode : molécule polaire ou apolaire
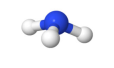
Dans la molécule d'ammoniac, l'atome d'azote est plus électronégatif que les atomes d'hydrogène.
Quel est le signe des charges partielles portées par l'atome d'azote ?
Et par les atomes d'hydrogène ?
Le centre géométrique des charges partielles négatives est-il confondu avec le centre géométrique des charges partielles positives ?
En déduire si la molécule est apolaire.
.
5. Répondre aux mêmes questions à propos de la molécule de dioxyde de carbone en sachant de l'atome d'oxygène est plus électronégatif que l'atome de carbone.