Définition :
Le potentiel standard d’oxydoréduction est une grandeur exprimée en volt (V) associée à un couple rédox. Il permet de situer le couple sur une échelle des couples rédox.
Par convention, le couple H+/H2 est associé au potentiel E0 H+/H2 = 0 V.
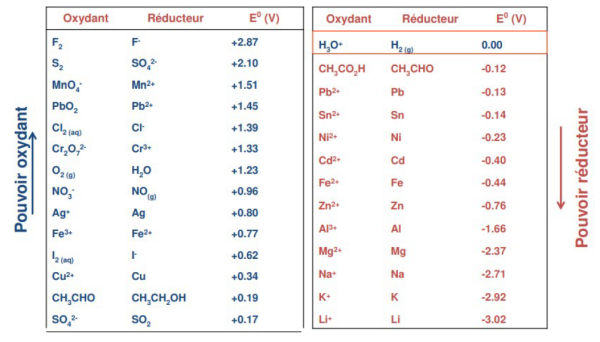
Plus le potentiel standard est élevé et plus l'oxydant du couple oxydant / réducteur considéré est fort, plus ce potentiel stand est faible et plus le réducteur correspondant est fort.
Dans ce tableau, l'oxydant le plus fort est le difluor « F2 »et le réducteur le plus fort est le lithium « Li ».
Méthode : réaction spontanée d'oxydoréduction
La réaction spontanée se produisant dans les conditions standards entre deux couples d’oxydoréduction est celle qui se produit entre l'oxydant le plus fort, de potentiel stand le plus élevé) et le réducteur le plus fort, ayant le potentiel standard le plus faible).
On applique « la règle du gamma ». On considère les deux couples d’oxydoréduction suivants : Ox 1 /Red 1 et Ox 2 /Red 2 avec E0(Ox2 / Red2) > E0(Ox1 / Red1).
L'oxydant 2 réagira donc avec le réducteur 1 pour former le réducteur 2 et l'oxydant 1.
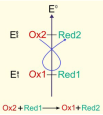
La réaction spontanée se produisant dans les conditions standards entre deux couples d’oxydoréduction est celle qui se produit entre l'oxydant le plus fort, de potentiel stand le plus élevé) et le réducteur le plus fort, ayant le potentiel standard le plus faible).
On applique « la règle du gamma » \(\gamma\). On considère les deux couples d’oxydoréduction suivants : Ox 1 /Red 1 et Ox 2 /Red 2 avec E0(Ox2 / Red2) > E0(Ox1 / Red1).
.
a) Utiliser le potentiel standard d'oxydoréduction du tableau précédent afin de déterminer quelle réaction chimique peut avoir lieu entre les couples H+ / H2 et Al3+ / Al.
b) Ecrire les demi-équations électroniques mises en jeu puis l'équation bilan de la réaction d'oxydo-réduction.
Peut-il y avoir une réaction d'oxydoréduction spontanée entre l'acide chlorhydrique (contenant des ions H+) et le métal cuivre ? Justifier votre réponse.
Ecrire l'équation bilan de la réaction d'oxydoréduction qui met en jeu les deux couples oxydant / réducteur suivants : I2 / I- et Fe3+ / Fe2+.
.