Problématique :
Le vinaigre d'alcool est une solution aqueuse contenant de l'acide éthanoïque. On peut l'utiliser en cuisine pour conserver les cornichons ou les petits oignons. Le vinaigre d'alcool contient entre 6 et 8 % d'acide éthanoïque.
Comment déterminer la concentration en acide éthanoïque dans le vinaigre en réalisant un titrage pH‑métrique ?
Matériel à votre disposition :
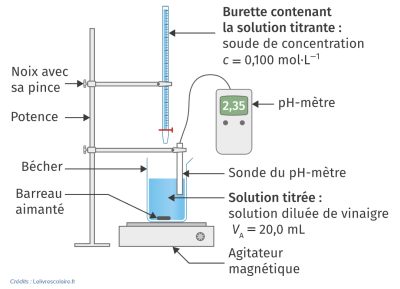
Potence, pince et noix de serrage
Burette graduée
Agitateur magnétique et barreau aimanté
Deux béchers de 250 mL
pH‑mètre étalonné
Flacon de vinaigre
Solution d'hydroxyde de sodium, c = 0,100 mol⋅L-1
BBT pour l'indicateur coloré
Pipette jaugée de 20,0 mL
Matériel pour dilution
Bocal pour la poubelle
Méthode :
Un titrage est une technique qui permet de déterminer la concentration d'une espèce chimique en solution reposant sur une réaction chimique, totale et rapide, entre l'espèce à titrer et l'espèce titrante.
Le titrage pH‑métrique est une méthode qui consiste à suivre l'évolution du pH d'une solution lorsqu'on y ajoute, petit à petit, une solution titrante. Il se produit une réaction entre un acide et une base, ce qui modifie le pH.
Lorsque les réactifs ont été introduits dans les proportions stœchiométriques, l'équivalence est atteinte. À ce moment‑là, le pH varie brusquement. La mesure du pH permet alors de déterminer le volume à l'équivalence VE et d'en déduire la concentration de l'espèce titrée dans la solution.
Conseil : Protocole expérimental :
Préparer la burette graduée avec la solution titrante d'hydroxyde de sodium.
Prélever avec une pipette jaugée les 20 mL de solution de vinaigre d'alcool diluée et l'introduire dans l'un des béchers.
Ajouter quelques gouttes de l'indicateur coloré, le bleu de bromothymol (BBT).
Rincer l'électrode du pH-mètre puis l'introduire dans le bécher ainsi que le barreau aimanté.
Réaliser un tableau de mesure pour relever la valeur du pH à chaque ajout de solution titrante mL par mL, jusqu'à un volume total de 25,0 mL. Pour la zone où l'on estime que se situe VE (entre 13 et 18 mL), effectuer des ajouts de 0,2 mL.
Relever la valeur du volume à l'équivalence.
Exploitation du titrage :
L'équation de la transformation qui a lieu lors du titrage est la suivante : CH3COOH + HO- = CH3COO- + H2O
Montrer que l'on a la relation suivante entre les quantité de matières : nACIDE = nBASE
En déduire la relation suivante pour la concentration en acide éthanoïque :
\(C_{ACIDE}=\frac{C_{BASE} . V_E}{V_{ACIDE}}\)
Déterminer la concentration en quantité de matière d'acide éthanoïque dans la solution de vinaigre diluée et en déduire la concentration massique correspondante sachant que la masse molaire de l'acide éthanoïque est de 60,1 g.mol-1.
En déduire la concentration massique de l'acide éthanoïque dans la solution initiale avant dilution en sachant qu'elle a été diluée 20 fois. Comparer avec la valeur indiquée sur l'étiquette de ce vinaigre.