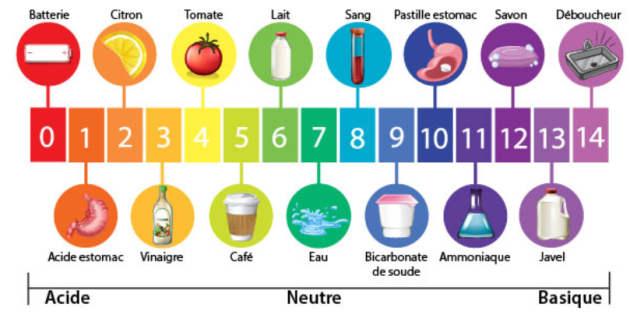
Echelle de pH
Le pH est une grandeur permettant d'évaluer si un milieu est acide, basique ou neutre.
Le pH peut prendre des valeurs comprises entre 0 et 14. Le pH ne possède pas d'unité.
une solution acide a un pH compris entre 0 et 7 : elle contient davantage d'ions oxonium H3O+ que d'ions hydroxyde HO-.
une solution basique a un pH compris entre 7 et 14 : elle contient davantage d'ions hydroxyde HO- que d'ions oxonium H3O+.
une solution neutre aura un pH égal à 7 : elle contient autant d'ions hydroxyde HO- que d'ions oxonium H3O+.
Comment mesurer la valeur du pH d'une solution ?
On peut déterminer le pH d'une solution en utilisant un indicateur coloré : sa couleur dépend de la valeur du pH de la solution.
On peut utiliser du papier pH : un papier indicateur de pH est un papier imbibé d'un mélange de plusieurs indicateurs colorés puis séché. Quand on dépose une goutte de solution à l'aide d'un agitateur en verre, il prend une couleur que l'on compare avec une échelle de teinte graduée en pH.
On peut utiliser un appareil, le pH-mètre, qui permet d'obtenir de manière plus précise la valeur du pH d'une solution.
Définition : Acide et base de Brönsted
Un acide de Brönsted est une espèce chimique susceptible de libérer un ou plusieurs protons H+.
Une base de Brönsted est une espèce chimique susceptible de gagner un ou plusieurs protons H+.
.
Définition : Couple acide / Base
Un acide et sa base conjuguée sont liés par une demi-équation qui fait intervenir un ou plusieurs protons :
Acide = Base + H+
L'acide et sa base conjuguée forment un couple "acide / base".
.
Exemple :
forme acide | forme basique | couple acide / base | demi-équation |
. H3O+ . | H2O | ||
. . . | H2O = HO- + H+ | ||
ion ammonium . . | ammoniac . . | NH4+ / NH3 | |
acide éthanoïque CH3COOH . | ion éthanoate CH3COO- . |
.