Pourquoi met-on du sel sur les routes dès les premières gelées ?
Extraits d'une activité du Livre Scolaire en classe de seconde.
Document 1 :
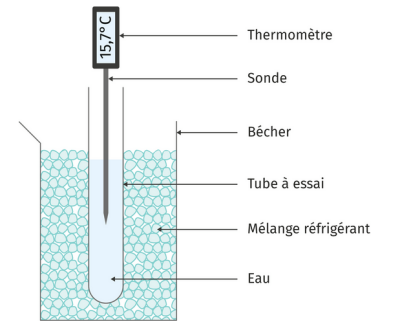
On souhaite suivre l'évolution de la température de l'eau distillée puis de l'eau salée au cours du refroidissement. On réalise l'expérience décrite ci-dessous :
introduire l'eau pure dans un tube à essai ;
introduire la sonde du thermomètre dans le tube à essai ;
placer le tube dans un bécher contenant le mélange réfrigérant (glace pilée et sel) ;
déclencher le chronomètre ;
relever la température toutes les minutes jusqu'à t = 25 min.
.
Reproduire l'expérience en remplaçant l'eau distillée par l'eau salée.
.
Document 2 ;
Solution 1 : eau distillée ;
Solution 2 : eau salée (réalisée par dissolution de 20 g de sel pour 100 mL de solution) ;
Température de fusion de l'eau pure : θt = θ °C ;
Température de fusion du sel : θt = 801 °C ;
Formule du chlorure de sodium solide : NaCl.
.
Document 4 :
Le mélange réfrigérant est constitué de 80 g de glace pilée et de 20 g de chlorure de sodium (sel de table). Ce mélange peut atteindre une température de -20 °C. Un mélange contenant 30 g de chlorure de calcium et 70 g de glace pilée permet de descendre jusqu'à une température de -55 °C.
Réaliser l'expérience et tracer la courbe montrant l'évolution de la température de l'eau au cours du temps en choisissant une échelle appropriée.
Déterminer la température de fusion de l'eau distillée.
Sur le même graphique, tracer la courbe donnant l'évolution de la température de l'eau salée au cours du temps.
Peut-on déterminer la température de fusion de l'eau salée ? Pourquoi ?
Comment distinguer un corps pur d'un mélange en utilisant les températures de changement d'état ?
Pourquoi l'ajout de sel sur les sols froids permet-il de limiter l'apparition du verglas en hiver ?