Rappel : des atomes aux molécules en passant par les ions...
A l'échelle microscopique, la matière est constituée d'atomes, de molécules ou d'ions.
Une molécule est constituée par un ou plusieurs éléments chimiques : la formule brute d'une molécule permet d'indiquer le nombre d'atomes de chaque type présents dans la molécule.
.
Exemple de la molécule de glucose : C6 H12 O6
Elle possède ... atomes de carbone, ... atomes d'hydrogène et ... atomes d'oxygène.
.
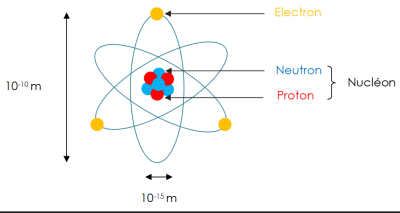
Complément : constitution de l'atome
Un atome est constitué de trois types de particules élémentaires (que l'on ne peut diviser) : protons, neutrons et électrons. L'atome est formé d'un noyau (constitué par les protons et les neutrons) et d'un cortège d'électrons qui gravitent autour du noyau.
Définition : les ions
Un ion est un atome qui ne possède pas le même nombre de protons que d'électrons.
Les cations sont des atomes qui ont perdu un ou plusieurs électrons, ils sont chargés positivement : H+, Ca2+...
Les anions sont des atomes qui ont gagné un ou plusieurs électrons, ils sont chargés négativement : O2-, Cl-...
.
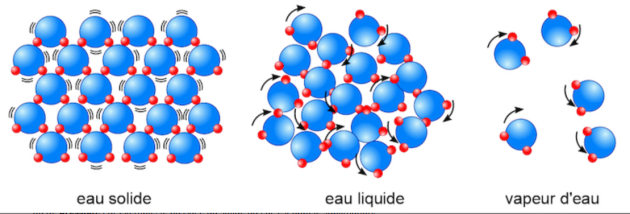
Rappel : description des états de la matière
La matière qui nous entoure peut se présenter à l'échelle microscopique sous trois états physiques différents :
l'état solide : les molécules de la matière sont liées les unes aux autres (elles ne peuvent pas se déplacer les unes par rapport aux autres) et organisées pour former une structure compacte et ordonnée.
l'état liquide : les molécules sont moins liées, elles se déplacent mais restent sous forme d'un ensemble compact.
l'état gazeux : les molécules sont indépendantes les unes des autres, elles occupent tout l'espace disponible ; l'état gazeux est totalement désordonné.
.
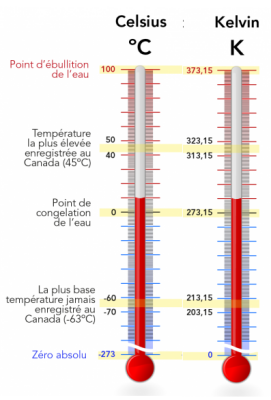
Définition : température absolue d'un corps
La température est une grandeur physique macroscopique qui permet de rendre compte de l'état thermique d'un corps.
Elle est un indicateur de l'agitation des particules constituant le corps.
Plus la température est élevée et plus les particules sont agitées.
.
On en utilise principalement deux échelles de température :
L'échelle Kelvin dite échelle absolue puisque la température T = 0 K est la plus petite température qui existe (elle correspond à une agitation nulle des molécules du corps).
L'échelle en degré Celsius (°C) fait référence à la température de solidification de l'eau pure.
T (en K) = θ (en °C) + 273,15
.
Méthode : notion de gaz parfait
A l'état gazeux, contrairement aux états solides et liquides, les molécules sont espacées et ont de faibles interactions les unes avec les autres.
Le gaz parfait est un modèle simplifié des gaz où l'on considère que les interactions entre les molécules de gaz sont nulles et peuvent être considérées comme des points matériels.
A basse pression, on peut considérer les gaz comme des gaz parfaits.
.
Les variables d'état, pression P, volume V, température T et quantité de matière n, d'un gaz parfait en équilibre et au repos sont liées par une relation appelée équation d'état des gaz parfaits :
.
\(P \times V = n \times R \times T\)
.
Remarques :
1 bar = 105 Pa
1 m3 = 1 000 L
P est la pression d'un gaz ( en Pascal, symbole Pa) ;
V le volume occupé par le gaz ( en m3 ) ;
n la quantité de matière ( en mol ) ;
R la constante universelle des gaz parfaits ( 8,314 J.K-1.mol-1 ) ;
T est la température ( en K ).
.