Rappel : quelques notions de base
Réaliser le test Quizlet nommé « Les états de la matière ». |  |
Loi de Charles
Visionner la vidéo proposée à partir de ce lien ou du Qrcode puis répondre aux questions suivantes (entourer les réponses correctes si nécessaire). |  |
Que représente la grandeur physique notée T ?
Que représente la grandeur physique notée V ?
Que représente la grandeur physique notée P ?
Que représente la grandeur physique notée n ?
Quelle relation de proportionnalité correspond à la loi de Charles ?
\(P = k \times T\)
\(k = P\times V\)
\(V = k \times T\)
\(V = k \times n\)
Un ballon de baudruche contient un nombre fixe de molécules d'air. On augmente la température de l'air à l'intérieur du ballon. Que se passe-t-il ?
le ballon se contracte
le ballon se dilate
la taille du ballon n'est pas modifiée
Loi de Gay-Lussac
Visionner la vidéo proposée à partir de ce lien ou du Qrcode puis répondre aux questions suivantes (entourer les réponses correctes si nécessaire). |  |
Que se passe-t-il si l'on refroidit un volume donné de gaz ?
la pression augmente
la pression reste constante
la pression diminue
Quelle(s) relation(s) corresponde(nt) à la loi de Gay-Lussac ?
\(T_1 = k \times P_1\)
\(T_2 = k \times P_2\)
\(V = k \times T\)
\(V = k \times n\)
\(k = \frac{P}{T}\)
.
Loi de Boyle & Mariotte et gaz parfaits
Visionner la vidéo proposée à partir de ce lien ou du Qrcode puis répondre aux questions suivantes (entourer les réponses correctes si nécessaire). |  |
Lorsque l'on diminue le volume occupé par un gaz : le nombre de molécules de gaz diminue :
le nombre de molécules de gaz diminue
le nombre de molécules de gaz augmente
la pression du gaz augmente
la pression du gaz diminue
le nombre de collisions des molécules de gaz entre elles et sur les parois augmente
le nombre de collisions des molécules de gaz entre elles et sur les parois diminue
Quel paramètre reste constant dans la loi de Boyle & Mariotte ?
la pression du gaz
la température du gaz
le volume du gaz
la quantité de matière du gaz
Attribuer la relation à la loi correspondante à la relation proposée (loi de Charles, loi de Gay-Lussac, loi de Boyle & Mariotte, loi d'Avogadro, loi des gaz parfaits) :
Relation
Loi
\(V = k \times n\)
\(V = k \times T\)
\(k = P\times V\)
\(P \times V = n\times R \times T\)
\(P = k \times T\)
.
Visionner la vidéo proposée puis répondre à la question suivante.
6. Pour qu'un gaz soit considéré comme parfait il fait que l'on soit dans les conditions suivantes :
Pression du gaz élevée | Volume du gaz élevé | Température du gaz élevée |
Pression du gaz faible | Volume du gaz faible | Température du gaz faible |
.
.

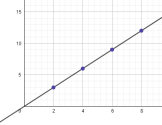
Rappel : proportionnalité entre deux grandeurs
Lorsque deux grandeurs A et B sont proportionnelles, on peut écrire la relation mathématique suivante entre elles :
A = k . B
k est appelé coefficient de proportionnalité.
La représentation graphique de A en fonction de B est alors une droite qui passe par l'origine du repère.
.
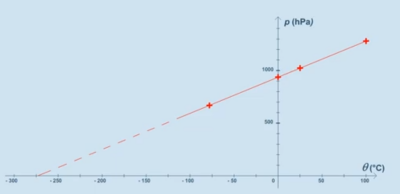
Exemple :
On dispose d'une bouteille en verre contenant de l'air et fermée. La quantité d'air et le volume d'air ne peut varier.
On relève la valeur de la pression pour différentes valeurs de la température notée \(\theta\) et l'on obtient le graphique ci-contre.
.
6. Peut-on affirmer que la pression est proportionnelle à la température du gaz exprimé en °C ? Justifier.
.
Découverte expérimentale de la loi de Boyle & Mariotte⚓
Relier la seringue fournie au pressiomètre de manière à emprisonner un volume d'air de 30 mL environ.
Compléter le tableau de mesures ci-dessous :
V en mL | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
P en ....... | ||||||||
Calcul de \(\frac {1}{V}\) |
.
3. Installer l'application gratuite nommée FIZZIQ sur votre smartphone. Lancer cette application.
Dans l'onglet « Mesures », sélectionner « Texte, tableau, photo » puis « tableau à deux variables.
Compléter les valeurs du volume dans la colonne 1 avec le titre « V » et les valeurs de la pression dans la colonne 2 avec le titre « P ».
Choisir pour le graphique l'affichage de la pression P en fonction du volume V.
4. Peut-on dire que la pression d'un gaz « P » est proportionnelle à son volume « V » d'après le graphique obtenu précédemment ? Justifier votre réponse.
5. Effectuer les calculs nécessaire pour la dernière ligne du tableau précédent. Tracer la courbe représentant la pression de l'air dans la seringue en fonction de \(\frac {1}{V}\). Conclure par rapport à la courbe obtenue.
.